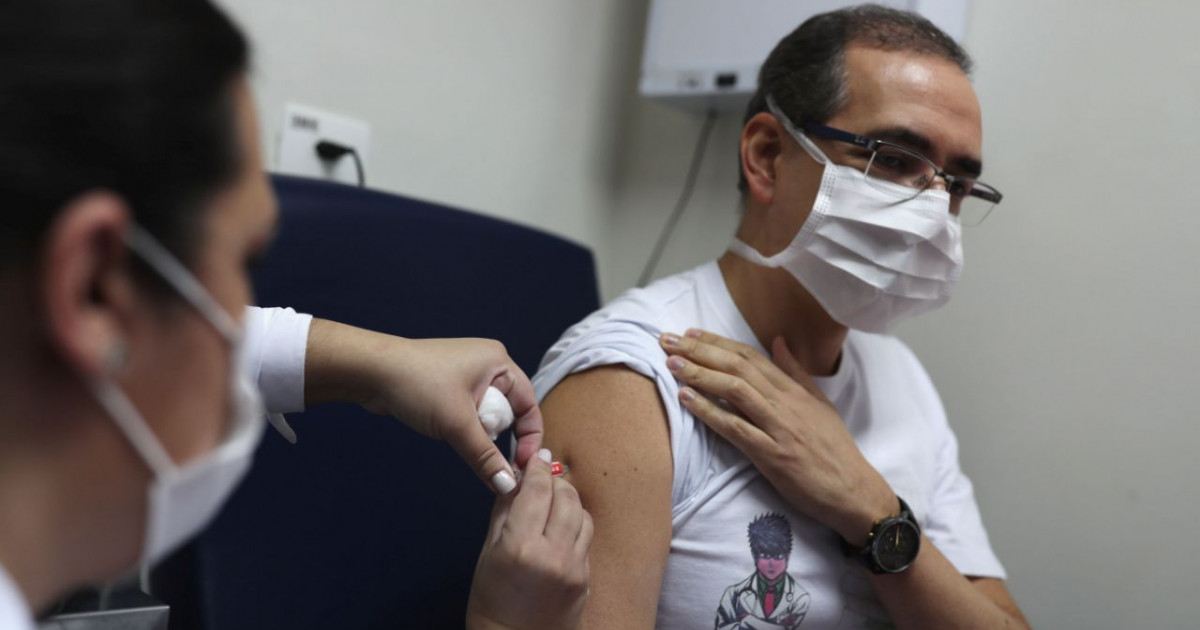
Brasil - Em meio a tratativas entre o Ministério da Saúde, governos estaduais e outros países para o acesso a candidatas a vacina contra a covid-19, apenas 3 ensaios clínicos na fase 3 estão em andamento no Brasil. É nessa etapa, que inclui milhares de voluntários, que a eficácia do imunizante é avaliada. No caso das 3 pesquisas, os resultados nas fases 1 e 2 em outros países foram promissores. Estão sendo testadas em brasileiros a vacina desenvolvida pela Universidade de Oxford, no Reino Unido, com a farmacêutica AstraZeneca; a produzida pela empresa chinesa Sinovac e a da farmacêutica americana Pfizer em parceria com a empresa alemã BioNTech. A vacina desenvolvida pela Rússia e anunciada, nesta semana, por Vladimir Putin como a primeira a ser aprovada no mundo, não está sendo testada no Brasil e o país nem divulgou os resultados das fases 1 e 2. Mesmo assim, o governo do Paraná anunciou que fechou um acordo com Moscou para testar a vacina no Brasil. O sucesso na fase 3 dos testes – que deve ser concluída no Brasil só em meados de 2021 nos 3 estudos, mas cujos resultados preliminares podem ser divulgados até o fim de 2020 – é necessário para as etapas seguintes até os postos de saúde. Os passos seguintes envolvem registro, produção ou compra em grande escala e definição da estratégia de vacinação. Os resultados são necessários para que a Anvisa (Agência Nacional de Vigilância Sanitária) conceda o registro da vacina. Também cabe à agência autorizar esse tipo de pesquisa. Esse tipo de solicitação para tecnologias ligadas à covid-19 tem sido atendida em 72 horas, segundo a Anvisa. Qualquer medicamento ou vacina passa pelas seguintes etapas fundamentais na Anvisa: desenvolvimento exploratório, pesquisa pré-clínica, pesquisa clínica (uso em humanos) e registro. Após o registro, a vacina é monitorada no mercado, de acordo com a agência. Em nota, a Anvisa disse que “a fase clínica [a fase 3 dos testes] serve para validar a relação de eficácia e segurança de um medicamento e também para validar novas indicações terapêuticas”, e que, no registro, ”é verificado se a vacina é fabricada e controlada dentro dos padrões de qualidade esperados pelos regulamentos técnicos”.
Entenda, abaixo, em que fase estão os testes das 3 vacinas no Brasil:
1) Universidade de Oxford + AstraZeneca
Quem coordena o estudo? A Unifesp (Universidade Federal de São Paulo) é responsável pelo estudo no Brasil, porém, a universidade e o Instituto D’Or se dividiram entre as praças: São Paulo, Rio de Janeiro e Salvador. A iniciativa é patrocinada pela Fundação Lemann em conjunto com a Rede D´Or. Quantas pessoas participam? 5.000 voluntários devem participar. Até agora, 3.436 foram vacinados, sendo 1.700 em São Paulo, 1.017 no Rio e 719 em Salvador. Como é o estudo? Um grupo recebe a candidata à vacina para covid-19 e outro, a vacina para meningite. O participante não sabe qual produto foi aplicado e profissionais da saúde têm sido priorizados entre os voluntários, porque é necessário que a pessoa se exponha ao vírus para saber se a vacina funciona. Os participantes não podem ter sido contaminados anteriormente. Idosos estão sendo testados? Na segunda-feira (10/8), a Anvisa autorizou que seja aplicada uma segunda dose da vacina nos voluntários e ampliou a faixa etária de 55 para 69 anos. A mudança foi feita com base em resultados de pesquisas. “A idade máxima teve a possibilidade de ser ampliada devido a dados que vieram dos testes nessa faixa-etária realizados no Reino Unido, os quais demonstraram que a vacina é segura o suficiente para ser aplicada nesse grupo”, afirmou a Unifesp, em nota. De acordo com a Unifesp, a vacinação dos voluntários idosos já foi iniciada e 500 pessoas voluntários desse grupo devem participar do estudo. O recrutamento dessa faixa etária também é feito prioritariamente com profissionais da área de saúde e com o risco aumentado de exposição. Por que uma segunda dose foi adicionada aos testes? De acordo com a universidade, “outros resultados divulgados por cientistas de Oxford concluem que a dose de reforço induziu uma maior produção de anticorpos em voluntários das fases 1 e 2 de testes da vacina”. Todos os voluntários que já receberam a primeira dose serão convocados para tomar o reforço entre 4 a 6 semanas depois da primeira imunização. Brasileiros terão acesso à vacina? Um acordo fechado pelo governo brasileiro com a AstraZeneca prevê o acesso a 100 milhões de doses, sendo 30 milhões entre dezembro deste ano e janeiro de 2021 e outras 70 milhões ao longo dos dois primeiros trimestres do próximo ano, se ela for comprovadamente eficaz e segura. Como o acordo prevê transferência de tecnologia, a Fiocruz também produzirá a vacina no Brasil. Como a vacina funciona? Chamada de ChAdOx1 nCoV-19, a vacina usa uma versão enfraquecida do vírus que causa o resfriado comum (adenovírus), contendo o material genético da proteína spike do SARS-CoV-2, que é a proteína usada pelo coronavírus para penetrar nas células. Quais foram os resultados nas fases 1 e 2? O imunizante desenvolvido pelos britânicos não causou efeitos adversos graves e provocou respostas imunes de anticorpos e das células T (um tipo de célula que identifica e mata invasores, também chamadas de linfócitos T), de acordo com os dados publicados na prestigiada revista científica Lancet em julho. Os dados se referem à reação de 1.077 adultos no Reino Unido nas fases iniciais. A vacina de Oxford usa uma versão enfraquecida do vírus que causa o resfriado comum (adenovírus), contendo o material genético da proteína usada pelo coronavírus para entrar nas células. (Photo: Amanda Perobelli / reuters)
2) Sinovac + Butantan
Quem coordena o estudo? O Instituto Butantan é responsável pela pesquisa no Brasil, mas ela é feita em 12 centros de recrutamento. São eles:
Hospital das Clínicas da Unicamp;
Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo;
Instituto de Infectologia Emílio Ribas;
Centro de Pesquisas Clínicas do Instituto Central do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo;
Instituto Israelita de Ensino e Pesquisa Albert Einstein;
Universidade Municipal de São Caetano do Sul;
Faculdade de Medicina de São José do Rio Preto;
Universidade de Brasília;
Universidade Federal de Minas Gerais;
Hospital das Clínicas da Universidade Federal do Paraná;
Hospital São Lucas da Pontifícia Universidade Católica do Rio Grande do Sul;
Instituto de Infectologia Evandro Chagas.
Quantas pessoas participam? A previsão é de que 9.000 voluntários participem. O Butantan não informou quantos foram selecionados até agora, mas disse que o recrutamento não começou no Einstein e no Evandro Chagas. Na UnB, a previsão é de 850 participantes. Em Ribeirão Preto, 500 foram vacinados. No Emíio Ribas, 30 pessoas receberam a primeira dose. Há uma lista de 1.500 cadastrados e 852 podem ser chamados inicialmente. Como é o estudo? Duas doses são aplicadas. Um grupo recebe a candidata à vacina para covid-19 e outro, um placebo. A metodologia do estudo é duplo-cego. “Nem o participante sabe o produto que recebeu, nem a equipe que administrou e nem a equipe que vai monitorar eventualmente se a pessoa tem uma reação; A ideia é que os resultados fiquem da maneira mais segura possível na interpretação, sem nenhuma tendência favorecendo a vacina. É uma maneira de provar a tese de que a vacina de fato funciona”, afirma Gustavo Romero, pesquisador da UnB e coordenador da pesquisa em Brasília. Idosos estão sendo testados? De acordo com a assessoria de imprensa do Butantan, idosos só serão incluídos após a Sinovac compartilhar resultados de testes da fase 2 neste grupo etário na China. Não há previsão de quando isso irá ocorrer. Brasileiros terão acesso à vacina? O acordo anunciado pelo governo de São Paulo entre o Butantan e a Sinovac envolve transferência de tecnologia para produção das doses no Brasil. Em entrevista à Folha de São Paulo, o diretor do Instituto Butantan, Dimas Covas, afirmou que, até dezembro, serão produzidas 15 milhões de doses, ainda que o ensaio clínico não esteja concluído. Ainda estão sendo feitas tratativas entre representantes da instituição ligada ao governo paulista e do Ministério da Saúde sobre uma eventual distribuição do imunizante pelo País. Como a vacina funciona? A Coronavac é feita com a inativação do novo coronavírus, uma forma tradicional de produzir vacinas. Quais foram os resultados nas fases 1 e 2? Resultados divulgados nesta semana mostram que, nas fases 1 e 2, as taxas de soroconversão [produção de anticorpos suficientes para ser detectado em exames] aumentaram mais de 90%. A microbiologista e fundadora do Instituto Questão de Ciência, Natália Pasternak fez ponderações sobre os resultados preliminares e afirmou que o declínio, com a idade, do número de anticorpos neutralizantes apontada no estudo pode significar mais uma dose para idosos. A Coronavac é feita com a inativação do novo coronavírus, uma forma tradicional de produzir imunizantes.
3) BioNTech + Pfizer
Quem coordena o estudo? Em São Paulo, as doses estão sendo aplicadas pelo Cepic (Centro Paulista de Investigação Clínica). Em Salvador, pela instituição filantrópica Obras Sociais Irmã Dulce. Quantas pessoas participam? Foram recrutados cerca de 100 voluntários na Bahia. A previsão é chegar a 500 participantes até o final deste mês. Em São Paulo, 150 pessoas receberam a primeira dose e outras 350 devem ser incluídas até o fim de agosto. Como é o estudo? Duas doses são aplicadas. Um grupo recebe a candidata à vacina para covid-19 e outro, um placebo. O participante não sabe qual produto recebeu. Duas doses serão aplicadas, com intervalo de 3 semanas entre elas. No Cepic, a previsão é que o acompanhamento dure 2 anos, com 6 visitas. Idosos estão sendo testados? Sim, a faixa etária é de 18 a 85 anos. De acordo com o diretor do Cepic, Juan Pablo Gargiulo, comparado com outras faixas etárias, a participação de voluntários acima de 60 anos é menor, “mas não foram poucas pessoas”. “A gente precisa de pessoas que tenham alguma exposição [ao vírus], mas não precisam ser profissionais da saúde. Pode ser uma pessoa que pega condução, policial, bombeiro, segurança, faxineiro, porteiro, uma pessoa que trabalhe no atendimento ao público. Em geral as pessoas com mais de 60 ano têm exposição”, afirma. Brasileiros terão acesso à vacina? O ministro interino da Saúde, Eduardo Pazuello, disse que a candidata à vacina da Pfizer está “no radar”, mas ainda não foi fechada uma parceria entre a farmacêutica americana e o governo brasileiro ou governos estaduais. Em julho, o governo dos Estados Unidos fechou um acordo para a compra de 100 milhões de doses, que é a previsão das farmacêuticas de produção para todo o ano. Como a vacina funciona? A técnica é mais moderna, com uso de RNA. Nenhum país usa essa tecnologia atualmente, então o acesso seria mais caro e a incorporação também seria mais difícil no Brasil do ponto de vista logístico, quando comparado às outras duas candidatas à vacina. Quais foram os resultados nas fases 1 e 2? A empresa alemã BioNTech e a farmacêutica Pfizer disseram que os dados de um estudo em estágio inicial mostraram que ela provocou resposta imune e foi bem tolerada. Uma pesquisa foi feita na Alemanha com 60 voluntários saudáveis revelou que o imunizante gerou um alto nível de respostas das “células T” contra o coronavírus. A técnica da Pfizer é mais moderna, com uso de RNA. Nenhum país usa essa tecnologia atualmente, então o acesso seria mais caro e a incorporação mais difícil no Brasil. (Photo: Reuters Photographer / reuters)Ver as imagens
Estratégia de vacinação
Além do registro, outra etapa que exige comprovação científica de segurança e eficácia é a incorporação ao SUS (sistema único de saúde). Pela legislação brasileira, para uma nova tecnologia ser incorporada ao SUS, é necessário ter registro aprovado pela Anvisa e aval da Conitec (Comissão Nacional de Incorporação de Tecnologias no SUS). O Ministério da Saúde promete que a estratégia de vacinação será unificada no País. “O entendimento que se tem hoje é nacional. É um programa nacional de imunização”, afirmou nesta quarta-feira (12) o secretário de Ciência e Tecnologia (SCTIE) da pasta, Hélio Angotti Neto. No mesmo dia, o governo do Paraná assinou um um acordo para desenvolvimento da vacina produzida pela Rússia, mesmo sem compartilhamento de informações científicas sobre o produto. O Instituto Butantan, ligado ao governo de São Paulo, por sua vez, tem uma parceria com a empresa chinesa Sinovac. Por enquanto, o único acordo do governo federal é com a AstraZeneca, farmacêutica detentora dos direitos de comercialização da vacina de Oxford. Na última semana, o presidente Jair Bolsonaro assinou a medida provisória (MP) que libera R$ 1,9 bilhão para viabilizar o acesso a 100 milhões de doses, por meio de uma parceria com transferência de tecnologia envolvendo Bio-Manguinhos, unidade da Fiocruz (Fundação Oswaldo Cruz) no Rio de Janeiro. Tanto Bio-Manguinhos quanto o Butantan têm se empenhado em adaptar as estruturas para conseguir produzir a vacina contra covid-19 em escala, caso ela se prove segura e eficaz. Em geral, cabe ao Ministério da Saúde, dentro do Programa Nacional de Imunizações (PNI), definir a estratégia de vacinação para qualquer doença no País, o que inclui decisões sobre grupos prioritários, número de doses e o calendário de distribuição. Em junho, a pasta anunciou que as 100 milhões de doses irão contemplar a cobertura vacinal dos seguintes grupos: idosos, pessoas com comorbidades, profissionais de saúde, professores, indígenas, pessoas em privação de liberdade, profissionais de segurança pública, de salvamento e motoristas de transporte coletivo. O esquema de vacinação deve ser escalonado, de maneira semelhante ao que ocorre com o calendário de imunização para gripe. Nas últimas semanas, contudo, integrantes do ministério têm dito que os critérios para essa escolha ainda não estão definidos. “Até pelo grande desconhecimento dessa doença em todo o mundo, pode haver uma variação do público alvo até iniciarmos a vacinação”, disse o secretário da SCTIE. De acordo com ele “serão feitas diversas análises epidemiológicas para ter o melhor plano de distribuição dessa vacina possível”. Os resultados desses estudos em fase 3 também são essenciais para definir quem deve receber o imunizante primeiro. “Outros grupos prioritários estão sendo discutidos, mas depende da vacina. Se a gente for falar de idosos, porque têm maior risco de adoecimento e de complicações e óbitos, do ponto de vista epidemiológico faz sentido, mas temos estudos de fase 3 realizados nesse grupo de idade que demonstrem eficácia e segurança nesse grupo de idade? Se não tiver, a gente não pode recomendar vacina para esse grupo de idade”, alertou a epidemiologista Cristiana Toscano, única brasileira no Grupo Consultivo Estratégico de Especialistas em Imunização da OMS (Organização Mundial da Saúde), em entrevista ao HuffPost Brasil.
Rússia não compartilha resultados
A vacina desenvolvida pela Rússia não está sendo testada no Brasil e o país não divulgou os resultados das fases 1 e 2. Na terça-feira (11/8), o presidente da Rússia, Vladimir Putin, disse que o país tornou-se o primeiro do mundo a dar aprovação regulatória para uma vacina contra a covid-19 com menos de dois meses de testes em humanos. A aprovação abre caminho para a imunização em massa da população russa, mesmo que o estágio avançado de ensaios clínicos para testar a eficácia e a segurança da vacina ainda não tenha sido concluído.A decisão do governo russo ocorreu antes do início de um teste mais amplo com milhares de voluntários. Em geral, é um requisito essencial para uma vacina receber aprovação regulatória. Mesmo sem essa informações, o governo do Paraná iniciou uma parceira para que o imunizante seja testado e produzido no Brasil. A expectativa é que até segunda-feira seja publicado um decreto pelo governo do estado do Paraná que permitirá definir, junto com os russos, um cronograma e plano de trabalho. O número de doses não foi informado. Será criado um grupo de trabalho para que os resultados das fases 1 e 2 na Rússia sejam compartilhados com o governo do Paraná e com o governo federal. A pesquisa e demais etapas no Paraná serão de responsabilidade do do Instituto de Tecnologia do Paraná (Tecpar), se houver liberação a Anvisa. Em nota, a Anvisa informou que “até o momento o laboratório russo responsável pelo desenvolvimento da vacina não apresentou nenhum pedido de autorização de protocolo de pesquisa ou de registro da vacina para a Anvisa”. De acordo com a agência, “também não há solicitação de qualquer entidade ou parceiro da referida vacina”. Quanto ao teste clínico de fase 3, a intenção é aplicar as doses em “profissionais da áreas de saúde que estão na ponta da linha do atendimento da pandemia” e “possivelmente com alguns grupos de risco”, segundo o diretor-presidente do Tecpar, Jorge Callado. Esses pontos também não foram formalmente definidos. Ao contrário de laboratórios de outros países, o russo Instituto Gamaleya não divulgou os resultados das fases 1 e 2 de testes da vacina batizada de Sputnik V. As informações sobre os testes na plataforma international Clinical Trials também foram alteradas após o anúncio do registro na Rússia, de acordo com a Folha de São Paulo. Antes do anúncio do governo russo, constava apenas o registro de uma primeira fase de testes iniciados em 17 de junho, com 38 pessoas, ainda em andamento. Após a repercussão internacional, foi incluída que uma segunda fase, concomitante à primeira, teria acontecido e que os estudos foram finalizados no dia 3 de agosto. Ainda não foram compartilhadas conclusões sobre os testes. Segundo a instituição russa, a fase 3 teria sido iniciada nesta quarta com 2.000 voluntários em países como Emirados Árabes Unidos, Arábia Saudita, Brasil e México.
Fontes: HuffPost Brasil / www.poptvnews.com.br